Lino Di Rienzo Businco, Dirigente U.O. Otorinolaringoiatria, Ospedale S.Spirito, Roma
Se volessimo identificare l’origine che ha segnato l’inizio della rivoluzione scientifica che oggi ci ha condotto alla possibilità di eseguire trapianti di tessuti e di cellule dovremmo risalire al primo trapianto d’organo effettuato negli anni ‘60.
Un nuovo settore della medicina e della chirurgia, come estrema evoluzione di quelle ricerche, denominato medicina e chirurgia rigenerativa si è andato sviluppando sempre più’ nel corso degli ultimi anni, guadagnando crescenti consensi ed attenzione delle riviste specializzate e dei mass media.
Fino a non molti mesi fa per numerose patologie degenerative non esistevano possibilità di cura (patologie oculari, neurologiche, dermatologiche, ematologiche, ecc), ma oggi grazie ai continui avanzamenti della ricerca sulle cellule staminali e sulle loro capacità rigenerative siamo finalmente giunti alle porte di una svolta che potrà modificare la prognosi per diverse malattie invalidanti ed a largo impatto sociale.
La maculopatia degenerativa, ad esempio, che rappresenta la prima causa di cecità, è stata per la prima volta trattata attraverso l’iniezione di cellule staminali nel fondo dell’occhio; questa terapia sperimentale mira alla sostituzione delle cellule malate, riparando i danni della retina, senza determinare effetti collaterali, mentre di impiego routinario sono già oggi i trattamenti della superficie oculare (cornea e congiuntiva) per patologie quali l’atrofia congiuntivale e la cherato-congiuntivite sicca (1).
Finalmente dopo molti anni di studi, l’idea di impiegare le cellule staminali per rigenerare tessuti danneggiati da malattie, invecchiamento o da interventi chirurgici demolitivi non è più un sogno irrealizzabile.
Nel 2012 è stata ulteriormente sancita la grande importanza e attualità dell’argomento con l’assegnazione del premio Nobel per la medicina a Jhon Gurdon e Shinya Yamanaka.
Gurdon cinquant’anni fa ha dimostrato che una cellula matura può eseguire il cammino inverso ed essere riprogrammata, rompendo cosi un dogma della biologia cellulare, e Yamanaka nel 2006 è riuscito a realizzare quel percorso a ritroso in grado di trasformare cellule mature sino allo stato primitivo di staminali pluripotenti, pronte per essere nuovamente indirizzate a differenziarsi in cellule altamente specializzate quali quelle cardiache o del sistema nervoso (4, 5).
Pietre miliari decisive per disporre di una fonte illimitata di cellule per essere utilizzate in sperimentazioni in vivo sul paziente e per superare definitivamente gli evidenti ostacoli etici legati all’impiego degli embrioni come fonte di prelievo delle cellule totipotenti.
Nel 2012 è stata ulteriormente sancita la grande importanza e attualità dell’argomento con l’assegnazione del premio Nobel per la medicina a Jhon Gurdon e Shinya Yamanaka.
Gurdon cinquant’anni fa ha dimostrato che una cellula matura può eseguire il cammino inverso ed essere riprogrammata, rompendo cosi un dogma della biologia cellulare, e Yamanaka nel 2006 è riuscito a realizzare quel percorso a ritroso in grado di trasformare cellule mature sino allo stato primitivo di staminali pluripotenti, pronte per essere nuovamente indirizzate a differenziarsi in cellule altamente specializzate quali quelle cardiache o del sistema nervoso (4, 5).
Pietre miliari decisive per disporre di una fonte illimitata di cellule per essere utilizzate in sperimentazioni in vivo sul paziente e per superare definitivamente gli evidenti ostacoli etici legati all’impiego degli embrioni come fonte di prelievo delle cellule totipotenti.
Dalla fine degli anni 90 sono iniziate le prime esperienze di Marx con l’utilizzo di emocomponenti ad uso non trasfusionale, relative all’utilizzo di concentrati piastrinici (plasma arricchito di piastrine, Platelet Rich Plasma – FATTORI DI CRESCITA ) in campo odontoiatrico (6, 7).
Dopo queste prioritarie sperimentazioni numerosi centri hanno allargato il campo di applicazione in diverse specialità mediche sino ad arrivare ai nostri giorni, in cui specificatamente il concentrato piastrinico ad uso non trasfusionale costituisce la fonte di fattori di crescita più utilizzata, per promuovere la rigenerazione dei tessuti danneggiati (8).
Le proprietà di stimolo rigenerativo efficace sia sui tessuti ossei che molli (migliore cicatrizzazione e riduzione di infezioni postoperatorie, dolore e perdita di sangue) ha portato questi emocomponenti ad essere oggi utilizzati routinariamente in varie branche della medicina e chirurgia, tra le quali ortopedia, chirurgia maxillo-facciale, odontostomatologia,ca rdiochirurgia, chirurgia plastica, dermatologia e più di recente nella chirurgia otorinolaringoiatrica (9, 10).
L’uso estensivo dei derivati piastrinici è stato certamente favorito dalla loro efficacia, unita ad un’estrema facilità d’uso e non ultimo dall’assenza di reazioni avverse.
Per citare alcuni esempi, attraverso le moderne possibilità della chirurgia Rigenerativa con fattori di crescita e precursori delle cellule staminali di origine piastrinica, miscelati con tessuto adiposo (PRL), ottenuti con un semplice prelievo di sangue e di grasso dello stesso paziente (autologo) opportunamente centrifugati e trattati, è già oggi possibile trattare ustioni gravi di 3° grado, ferite difficili, decubiti, ricostruzioni mammarie dopo mastectomia, patologie dello scheletro osseo facciale, inestestismi cutanei (11, 12, 13).
In ambito Otorinolaringoiatrico, nella nostra esperienza degli ultimi anni, i risultati più promettenti e funzionalmente efficaci si sono ottenuti in rinologia nel trattamento degli esiti demolitivi di pregresse chirurgie nasali (turbinectomie parziali o totali, perforazioni del setto nasale) che determinano sindromi ostruttive nasali da eccessivo svuotamento delle cavità nasali (Empty Nose Syndrome) e riniti crostose persistenti e in otologia nel trattamento delle perforazioni della membrana timpanica (conseguenze di traumi o otiti perforative).
Tali interventi riparativi delle sedi ORL sono caratterizzati da una bassissima invasività con rapido decorso postoperatorio (day surgery), dalla agevole disponibilità di un tessuto biologico autologo senza necessità di eseguire prelievi tissutali da altri siti anatomici (mucosa nasale, fascia muscolare, lembi osteo-cartilaginei, ecc) e soprattutto dall’estrema sicurezza per assenza di effetti collaterali.
Il cardine di questa Chirurgia Rigenerativa ORL è rappresentato da 3 elementi, i fattori di crescita contenuti in un gel piastrinico, le cellule staminali ottenute dal tessuto adiposo (ev.miscelate con il FATTORI DI CRESCITA per ottenere il PRL) e i biomateriali di sintesi (acido ialuronico, collagene).
Ben note sono le capacità emostatiche delle piastrine e il loro complesso meccanismo d’azione (più di 300 proteine) ma solo ultimamente, con i progressi della biologia molecolare, si è arrivati a comprendere i differenti meccanismi che intervengono nel rilascio dei fattori di crescita.
Le piastrine, una volta attivate, rilasciano i fattori di crescita contenuti negli alfa-ganuli capaci di esplicare specifiche funzioni nella rigenerazione delle cellule e nello sviluppo del tessuto in cui sono liberati.
Dentro le piastrine sono infatti contenute le proteine GF (growth factors), fattori di crescita implicati nella rigenerazione dei tessuti che hanno subito un danneggiamento. Il FATTORI DI CRESCITA contiene differenti tipologie di GF (isomeri del GF piastrinico, transforming GF β1 e β2, GF insulinico α e β, GF vascolare endoteliale) in grado di promuovere rigenerazione ossea e di indurre la differenziazione delle cellule pluripotenti.
I GF agiscono come segnali di attivazione per attirare cloni di cellule staminali nel sito sede del danno e sono in grado contemporaneamente di innescarne la loro proliferazione.
L’azione dei GF sugli osteoblasti è ad esempio in grado di indurre mitosi e stimolare la migrazione di progenitori cellulari mesenchimali. Lo stimolo chemotattico e mitogenetico del FATTORI DI CRESCITA sulle cellule mesenchimali staminali determina la riparazione e rigenerazione del tessuto danneggiato, in maniera proporzionale con la concentrazione piastrinica (efficacia dose-dipendente) (9, 14, 15, 16)
La preparazione del FATTORI DI CRESCITA avviene tramite sistemi chiusi certificati con la collaborazione nella preparazione del medico trasfusionista, che permettono la raccolta di un volume di 8-10 ml di sangue intero. Al prelievo segue la fase di centrifugazione a 1500 giri per 10 minuti, con conseguente separazione nella provetta tra globuli rossi (sul fondo) e concentrato piastrinico (sovranatante) (10, 17).
La nostra esperienza è basata sull’utilizzo da 5 anni del sistema RegenLab (Le Mon-sur-Lausanne, Switzerland) con tubi auto caricanti da 8 ml che dopo centrifugazione producono concentrati di 3-4 ml di FATTORI DI CRESCITA . Il FATTORI DI CRESCITA così ottenuto può essere utilizzato in forma liquida o in forma gel a seconda delle necessità per la patologia del paziente con le seguenti procedure:
- Trasferito in siringa è pronto per essere infiltrato nei tessuti molli (ad es.turbinati), dopo attivazione con calcio gluconato o calcio cloruro (10% del volume totale di FATTORI DI CRESCITA ).
- Trasferito in un dispositivo appropriato e addizionato al calcio gluconato e alla trombina autologa (da sovranatante di prelievo ematico centrifugato a 3000 giri per 10 minuti senza anticoagulante, 20% del volume totale di FATTORI DI CRESCITA ) va incontro a gelificazione e può essere utilizzato come membrana da applicare in sede di lesione da colmare (ad es.membrana timpanica).
Tutti e due i prodotti sono di semplice ottenimento e la modalità di preparazione garantisce la sterilità eseguita con sistema chiuso certificato (marchio CE).
Gli effetti clinici del FATTORI DI CRESCITA (18, 19) sui tessuti impiantati sono riassumibli in una biostimolazione con:
- proliferazione cellulare
- processi bioriparativi e rigenerativi
- angiogenesi e rivascolarizzazione dei tessuti
- proliferazione delle cellule mesenchimali
- produzione di fibroblasti
- produzione di collagene
Nell’impiego nasale, abbiamo messo a punto da alcuni anni l’innesto della miscela rigenerativa di FATTORI DI CRESCITA (con rilascio di fattori di crescita che richiamano progenitori cellulari e li stimolano a proliferare) arricchita con le staminali ottenute dal tessuto adiposo (PRL) per il trattamento della Empty Nose Syndrome; tale impianto viene eseguito per via endoscopica nasale con aghi da spinale per raggiugere tutte le sottosedi nasali ed i compartimenti dei turbinati che necessitano di rigenerazione.
La stessa tecnica endoscopica è stata da noi impiegata nel trattamento delle perforazioni del setto nasale con la differenza che la sostanza rigenerativa FATTORI DI CRESCITA viene preparata sotto forma di sottile membrana per meglio colmare la perdita di sostanza della perforazione e facilitare l’ancoraggio ai margini mucosi perforati.
Nelle indicazioni otologiche, il FATTORI DI CRESCITA è risultato particolarmente indicato per le perforazioni della membrana timpanica ove il potenziale rigenerativo descritto offre migliori possibilità di attecchimento del neotimpano , insieme all’indiscutibile vantaggio, come detto, di evitare al paziente il prelievo di fasce muscolari e altro materiale autologo o eterologo per colmare il difetto.
L’esperienza clinica che abbiamo maturato negli ultimi anni con la chirurgia rigenerativa ORL ha dimostrato soprattutto a livello nasale grande efficacia nei processi di rigenerazione della mucosa e della sua funzionalità con attivazione di proliferazione cellulare e guadagno di volume (ricostruzione dei turbinati).
In conclusione la chirurgia rigenerativa si propone anche in otorinolaringoiatria ed in particolare nel distretto nasale, come la possibilità più promettente per la risoluzione miniinvasiva di molti problemi legati alla difettosa funzionalità del naso specie dopo precedenti chirurgie demolitive, grazie alle capacità delle nuove miscele di aiutare a ricostruire forma e funzione della zone anatomiche danneggiate.
- Sicurezza per il paziente, nessun rischio di trasmissione malattie infettive
- Prodotto autologo
- Sistema chiuso/sterile certificato
- Performances riproducibili di alta qualita’
- Volume del FATTORI DI CRESCITA adeguabile alle diverse esigenze
- Eccellenti possibilita’ di manipolazione
- Ricavato da piccole quantita’ di sangue intero
- Elevata concentrazione di fattori di crescita, citochiine e proteine attive
Caratteristiche del FATTORI DI CRESCITA
Contributo sperimentale
La chirurgia per l’ipertrofia dei turbinati è molto comune e rappresenta l’ottava procedura in ordine di frequenza eseguita in ambito otorinolaringoiatrico (20).
Nel corso degli anni sono state proposte numerose tecniche chirurgiche per il trattamento dell’ipertrofia dei turbinati inferiori, il cui principale problema era aumentare lo spazio respiratorio nasale preservando la funzione della mucosa di rivestimento, sede di importanti azioni protettive e di assorbimento di farmaci utili nel trattamento postoperatorio a lungo termine della flogosi sottomucosa (turbinectomia, svuotamento sottomucoso con o senza debrider, criocoagulazione, elettrocausticazione mono o bipolare, Laser CO2 e diodi, radiofrequenze, coblator).
Prima del diffondersi delle tecniche miniinvasive di shrinkage dei turbinati senza danno termico, molte delle tecniche più vecchie ed in particolare quelle ad alte temperature con elettrobisturi e quelle estremamente demolitive con forbici con amputazione parziale o completa del turbinato, sebbene garantissero un apparente aumento del flusso aereo nasale, erano accompagnate dalla perdita della sensibilità nasale con danneggiamento dei recettori mucosali, della percezione del passaggio d’aria e dalla formazione di vortici aerei sino a vere e proprie sindromi “Empty nose” con formazioni di croste, sanguinamenti e sinechie, con impatto fortemente negativo sulla qualità della vita dei pazienti (20, 21, 22).
In questi casi di danno iatrogeno con ENS le terapie mediche (antistaminici, steroidi, immunoterapia specifica nasale, soluzioni per lavaggio nasale) si dimostrano invariabilmente insufficienti a risolvere i sintomi nasali ostruttivi e flogistici del paziente, la qualità della vita si riduce in modo considerevole con scarse possibilità da parte del medico di migliorare il quadro clinico locale nasale.
In questo studio abbiamo voluto verificare efficacia e sicurezza di una nuova tecnica endoscopica messa a punto per la ricostruzione dei turbinati atrofici e parzialmente amputati in quanto coagulati o resecati da precedente chirurgia nasale, in aggiunta a trattamento medico topico a base di lavaggi con acqua termale e unguento umidificante vitaminico.
Tale tecnica chirurgica endoscopica ricostruttiva è basata sull’impiego del FATTORI DI CRESCITA miscelato a grasso autologo (12) da prelievo periombelicale (PRL), che è stata eseguita su un gruppo di pazienti affetti da ENS, confrontando i risultati funzionali con un gruppo omogeneo di controllo con ENS sottoposto a sola terapia medica.
Abbiamo voluto confrontare la variazione di parametri clinico-strumentali e sintomi ad inizio e fine trattamento suddividendo pertanto i pazienti in due gruppi di studio, il primo A con sola terapia medica farmacologica ed il secondo B con la stessa terapia medica cui è stato aggiunto un trattamento endoscopico con PRL sulla regione dei turbinati inferiori precedentemente amputati.
Materiali e metodi
Per lo studio sono stati arruolati in modo consecutivo 46 pazienti (39 maschi) di età maggiore di 18 anni (Tab.I) previa valutazione ORL completa con esame clinico obiettivo, endoscopia, valutazione allergologica e questionario SNOT-22, sottoposti da più di 3 anni presso altre sedi, ad intervento di turbinectomia o elettrocauterizzazione dei turbinati inferiori per loro ipertrofia, con conseguente esito di ENS. 16 pazienti presentavano positività allergeniche cutanee agli skin prick-tests per acari (Dermatophagoides pteronyssinus o Dermatophagoides farinae) or pollini (Graminacee, Cupressus or Parietaria ).
| Gruppo A (n=23) |
Gruppo B (n=23) |
p-value | ||
| Età (anni) | 39.3 ±2.02 | 41.5 ±2.08 | ns | |
| Maschi | 19(82.6%) | 20(86.9%) | ns | |
| Femmine | 4(17.4%) | 3(13.1%) |
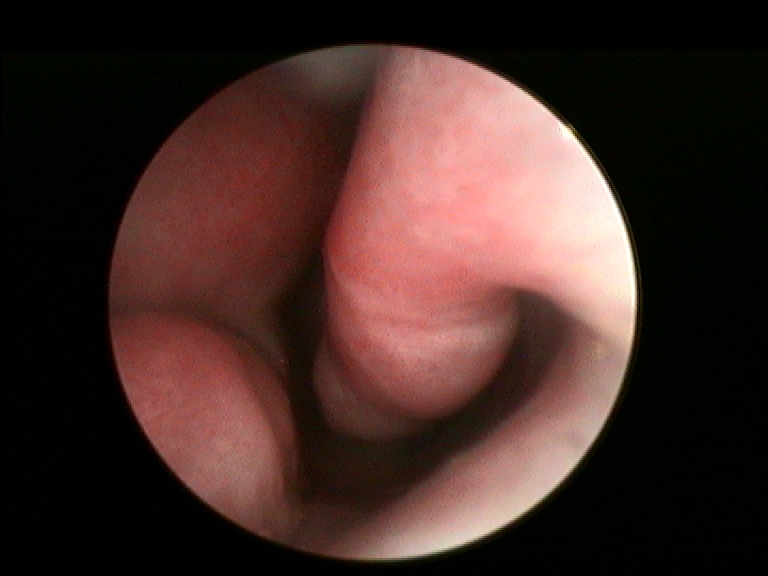
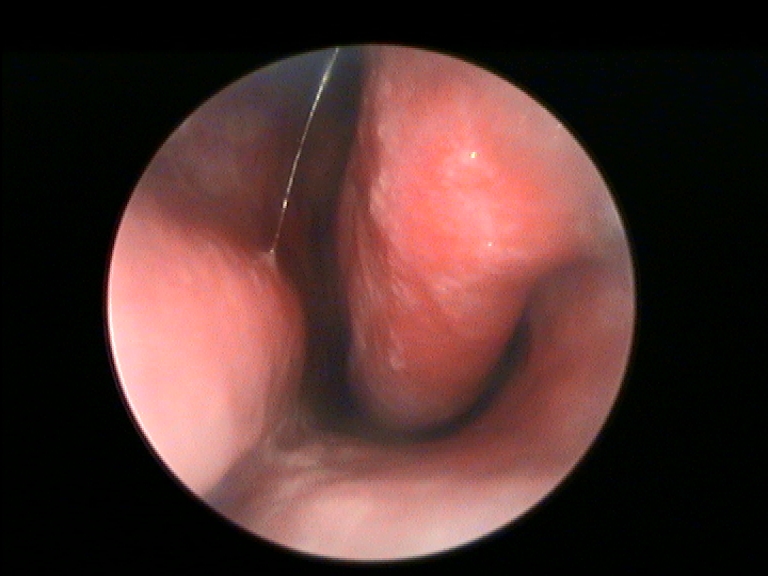
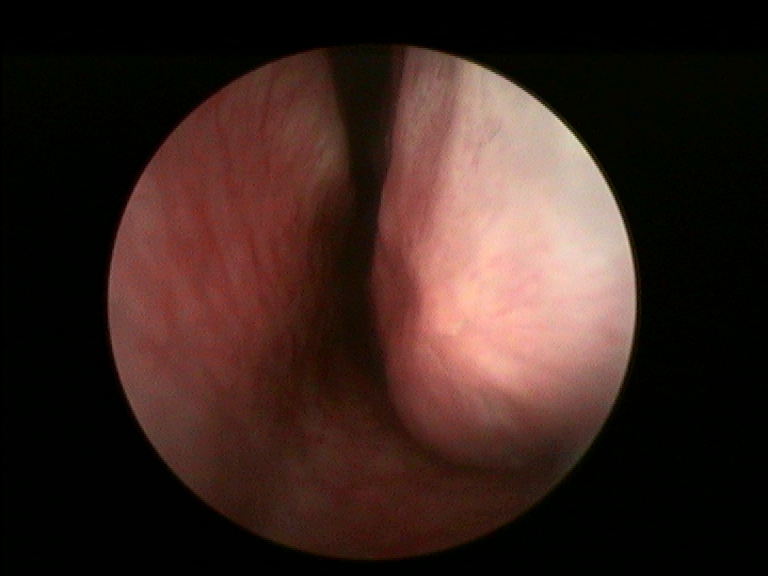
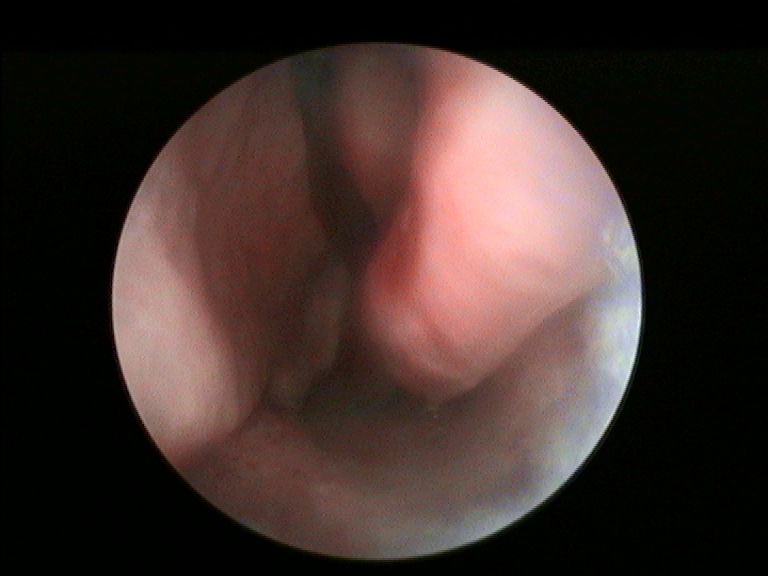
I criteri di inclusione dei pazienti nello studio erano: fallimento di ogni trattamento medico precedentemente eseguito, sintomi ostruttivi nasali alla VAS maggiori di 5 (min 0-max 10), documentata resezione dei turbinati inferiori per una superficie uguale o maggiore del 50% all’esame endoscopico e TC. Per la valutazione del danno da resezione a carico del turbinato inferiore è stata utilizzata la nostra classificazione compartimentale dei turbinati al fine di quantificare in maniera obiettiva la sede e la porzione amputata (Fig.1 e 2) (20).
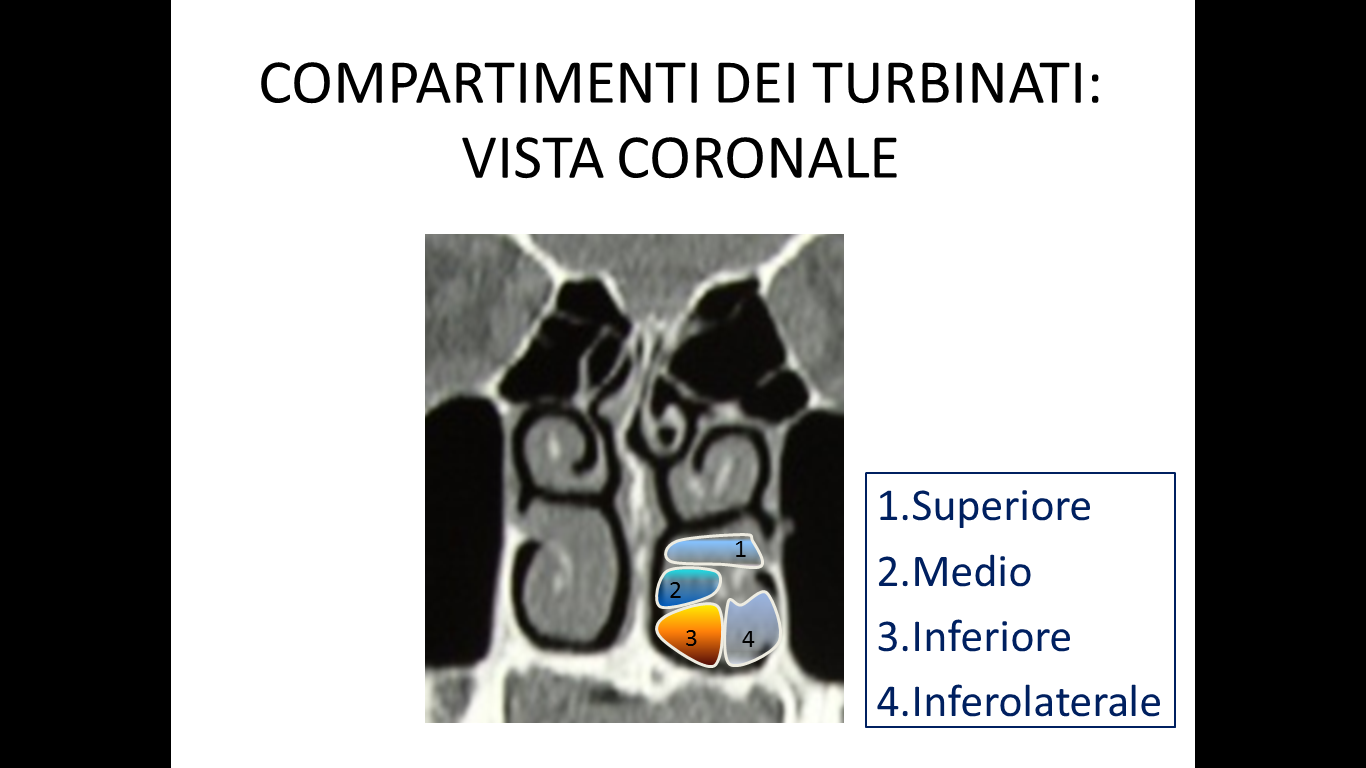
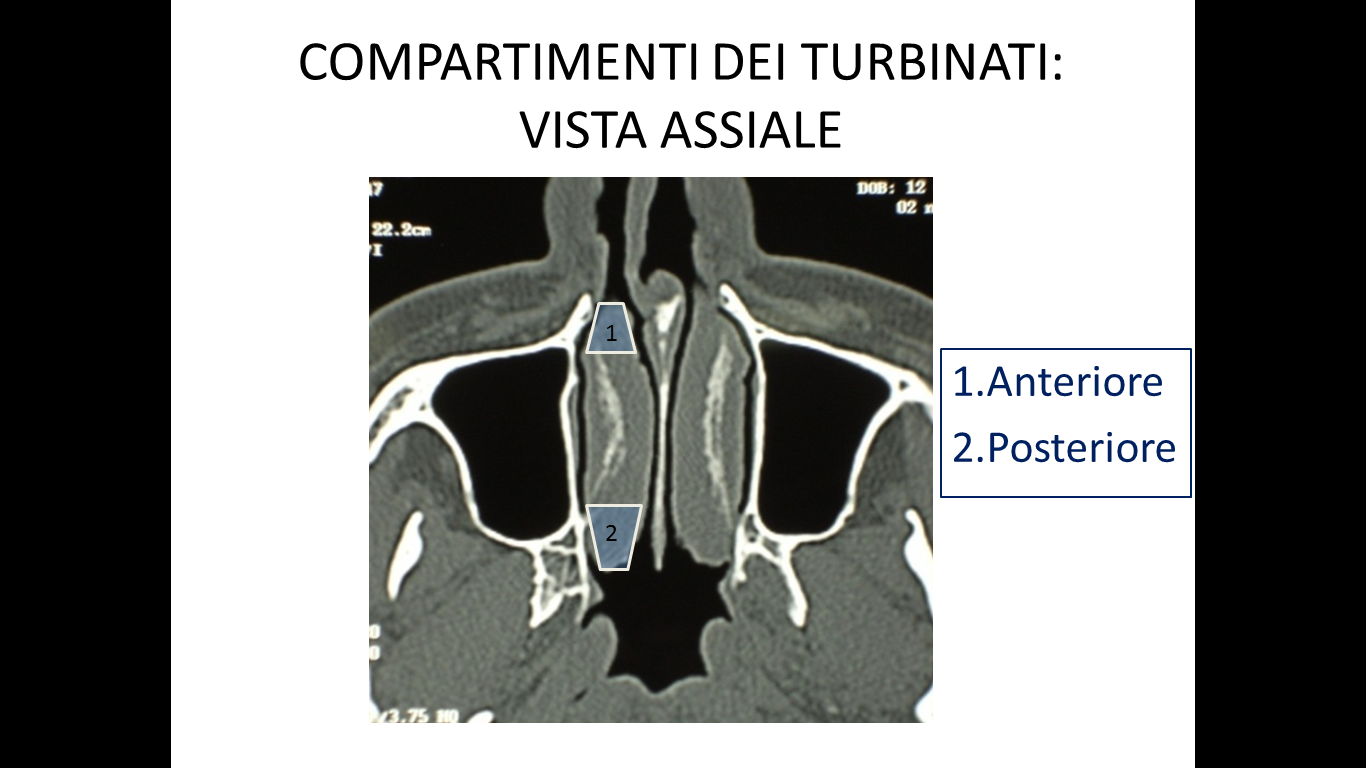
**********Tutti i pazienti hanno firmato il consenso informato e lo studio ha ricevuto l’approvazione del Comitato Etico locale.
Study design
Tutti i pazienti sono stati alternativamente assegnati a 2 gruppi omogenei (A: controllo, solo terapia medica e B: terapia medica e trattamento chirurgico ricostruttivo) ciascuno di 23 pazienti. La randomizzazione dei pazienti per essere sottoposti a trattamento A o B è stata ottenuta con una sequenza di numeri random da una sequenza generata dal computer.
Il trattamento medico era basato sulla somministrazione intranasale spray di una soluzione di acqua termale salso-bromo-iodica (3 spruzzi per narice 3 volte al giorno) insieme all’applicazione serale di un unguento nasale a base di vitamina E.
I pazienti del gruppo B, prima dell’inizio della terapia medica, sono stati sottoposti a ricostruzione endoscopica dei turbinati inferiori con FATTORI DI CRESCITA miscelato a grasso autologo (PRL). Ad entrambi i gruppi è stato richiesto di annotare ogni eventuale effetto collaterale emerso durante lo studio.
Preparazione del FATTORI DI CRESCITA
Esistono 2 modalità di preparazione del FATTORI DI CRESCITA : un metodo manuale e un metodo basato su dispositivi automatici o semiautomatici (23). Il processo di preparazione consiste in 4 fasi; prelievo ematico, centrifugazione per ottenere un concentrato piastrinico, induzione del processo di gelificazione (se necessaria la forma gel del FATTORI DI CRESCITA ) e attivazione.
Previo prelievo ematico da vena periferica, il sangue viene addizionato con sodio citrato come anticoagulante. Il metodo di preparazione manuale del FATTORI DI CRESCITA consiste in una lenta centrifugazione che consente alle piastrine di rimanere in sospensione con il plasma mentre i leucociti e gli eritrociti si depositano sul fondo della provetta. La centrifugazione rapida determinerebbe invece una forza meccanica ed un’elevazione della temperatura, in grado di indurre modificazioni ultrastrutturali delle piastrine che portano ad una parziale attivazione con degranulazione e conseguente riduzione dell’efficacia del FATTORI DI CRESCITA una volta impiantato (10, 23).
Sono impiegati diversi protocollo di centrifugazione per la preparazione del FATTORI DI CRESCITA (1500 giri/minuto per 10 minuti il nostro). Dopo la centrifugazione il sovranatante di piastrine e leucociti viene prelevato con 9 ml di plasma.
Il cloride di calcio viene aggiunto al FATTORI DI CRESCITA cosi ottenuto per attivare le piastrine e stimolare la secrezione dei fattori di crescita con esocitosi degli alfa-granuli.
Preparazione del grasso
Il grasso purificato è ottenuto dopo prelievo transombelicale con microcannule da lipoaspirazione (diametro 1,5 mm), mediante centrifugazione per 3 minuti a 3000 giri/minuti (tecnica di Coleman) e inserito asetticamente in una siringa da 1 ml miscelato con FATTORI DI CRESCITA .
Questa procedura consente di ottenere un grasso purificato preservando l’integrità degli adipociti, ma separando la componente fluida da quella sieroematica (24, 25).
PROCEDURE group B:
I pazienti in trattamento sono stati preparati 15 minuti prima della ricostruzione dei turbinati con anestesia locale per contatto mucoso con Lidocaina su cotonoidi posizionati lungo tutta la lunghezza del meato inferiore. E’ stata adoperato un endoscopio nasale 3 mm 0° (Karl Storz, Tuttlingen, Germany) per eseguire in modo selettivo l’infiltrazione dei compartimenti dei turbinati sotto guida endoscopica. La soluzione di PRL è stata iniettata nei siti sede di pregressa causticazione o amputazione del turbinato mediante siringa da 5 ml con ago da spinale 22G da 90 mm
La procedura non ha determinato sanguinamenti significativi ad eccezione di una modesta quantità dal sito di iniezione (gocce), che non ha mai richiesto tamponamento nasale nè sospensione della procedura.
Clinical outcomes
ll’inizio dello studio (T0), è stato richiesto ad ogni paziente di indicare la gravità dei sintomi nasali soggettivi su una scala VAS (0 min-10 max) (ostruzione nasale, secrezione nasale, starnuti, prurito, dolore).
A tutti i pazienti è stato somministrato prima e dopo il trattamento il questionario SNOT-22 e sono stati confrontati i risultati con riguardo alle 5 domande più importanti (5 most important items). Tutti i pazienti sono stati sottoposti a Rinomanometria anteriore basale per valutare le resistenze nasali (Rinomanometro Labat srl, Venezia, Italia) effettuata durante il giorno.
In accordo con il Comitato Internazionale per la standardizzazione della rinomanometria, le resistenze al flusso aereo nasale erano misurate a pressione standard (150 Pa) e le resistenze nasali totali erano calcolate dalle registrazioni rinomanometriche monolaterali (26). Le misurazioni AAR non erano effettuate se il paziente era in periodo sintomatico di raffreddore comune acuto o crisi allergica nasale, rinviando la misurazione alla risoluzione della fase acuta, e i pazienti con grave ostacolo completo alla respirazione nasale con impossibilità a registrare il valori rinomanometrici erano esclusi dallo studio.
Le misurazioni AAR sono state eseguite in posizione seduta dopo periodo di acclimatamento di 15 minuti nella stanza, a condizioni standard di temperatura ambientale ed umidità.
È stato assegnato a cisacun paziente uno score rinoendoscopico a gravità crescente 1-4 all’inizio e al termine dello studio, basato sul volume della crostosità nasale in relazione all’ostacolo respiratorio (da 1: croste a piatto sulla superficie mucosa minimamente ostruenti il lume respiratorio, sino a 4: croste a ponte tra parete nasale e setto completamente ostruenti).
Allo scopo di ottenere un dato funzionale sullo stato della mucosa nasale nei due gruppi di studio, è stato calcolato il Tempo di Trasporto Muco-Ciliare (TMCt), prima e dopo il trattamento.
Tutti i pazienti sono stati sottoposti a valutazione del MCTt nasale, utilizzando una miscela di polvere di carbone vegetale e saccarina al 3%. Il MCTt è stato calcolato come l’intervallo di tempo intercorso dal momento in cui è stata posizionata la polvere sulla testa del turbinato inferiore (compartimento anteriore) sino a quando una striscia della stessa polvere compariva in orofaringe all’esame faringoscopico diretto (27).
Il tempo di clearence della saccarina è stato invece calcolato considerando il termine del test nel momento in cui il paziente percepiva e riferiva un sapore dolce in bocca.
Tutte le valutazioni e i test sono stati ripetuti e confrontati con quelli basali dopo 12 mesi di trattamento per entrambi i gruppi di studio.
In 3 pazienti del gruppo B è stato possibile dopo oltre 1 anno dal trattamento, effettuare una biopsia per esame istologico della regione del turbinato ricostruita con PRL nel corso di altri interventi eseguiti per indicazioni diverse dal naso.
Le sezioni di mucosa del turbinato di 5µm sono state preparate secondo la procedura standard dopo inclusione in paraffina e colorate con ematossilina-eosina.
Analisi statistica
Per tutti i parametri soggettivi ed oggettivi è stato utilizzato il valore p (test Student, con significatività per p ‹0.05).
Le analisi statistiche sono state effettuate con SPSS (pacchetto software per analisi statistica) versione 17.0 (Chicago, IL, USA).
Risultati
Lo studio includeva 46 pazienti di età compresa tra 32-67 (tab. 1) senza differenze statisticamente significative tra i due gruppi (tab. 2).
| Group | Control A (n=145) |
Treatment B (n=145) |
p-value |
| Nasal Obstruction (Mean ± SD) |
9.11 ± 0.85 | 9.63 ± 0.61 | 0.21 |
| Itching | 8.89 ± 1.10 | 9.11 ± 0.91 | 0.15 |
| Rhinorrhea | 9.12 ± 1.00 | 9.40 ± 0.83 | 0.21 |
| Sneezing | 8.20 ± 1.11 | 8.40 ± 1.31 | 0.17 |
| Rhinoendoscopy Clinical Score | |||
| 1 | 0 | 0 | 0.87 |
| 2 | 0 | 0 | |
| 3 | 55(37.9%) | 61(42.1%) | |
| 4 | 90(62.1% | 84(57.9%) | |
I pazienti del gruppo B non hanno riferito dolore durante e dopo la procedura, ma solo sporadici casi di bruciore nasale e minime secrezioni frammiste a sangue dopo aver soffiato il naso, per cui è stato prescritto paracetamolo al bisogno (compresse 500 mg) nel periodo postoperatorio senza nessun evento avverso riportato. In particolare non si sono verificati casi di epistassi ne alcuna complicanza generale o locale a livello dei siti nasali trattati con PRL (sinechie, crostosità).
La sede di prelievo del grasso ombelicale è guarita senza reliquati ed i punti di sutura sono stati rimossi in 5-7 giornata postoperatoria.
Per quanto riguarda i sintomi soggettivi nasali (ostruzione, stranutazione, rinorrea, prurito e dolore) e l’obiettività endoscopica nasale è stato evienziato un miglioramento statisticamente significativo nel gruppo B (p<0.05) (tabella 3).
|
Group |
Control A (n=145) |
Treatment B (n=145) |
p-value |
| Nasal Obstruction (Mean ± SD) |
6.11 ± 0.55 | 3.23 ± 0.51 | p<0.05 |
| Itching | 7.19 ± 1.4 | 4.1 ± 0.81 | p<0.05 |
| Rhinorrhea | 8.2 ± 1.10 | 5.20 ± 0.73 | p<0.05 |
| Sneezing | 7.21 ± 1.12 | 5.20 ± 1.21 | p<0.05 |
| Rhinoendoscopy Clinical Score | |||
| 1 | 0 | 51 (35.2%) | p<0.05 |
| 2 | 32 (22.1%) | 60 (41.4%) | |
| 3 | 81 (55.8%) | 34 (23.4%) | |
| 4 | 32 (22.1%) | 0 | |
Per quanto concerne la valutazione oggettiva rinomanometrica è stato osservato un andamento simile a quanto rilevato per i sintomi soggettivi nasali, con un miglioramento a favore del gruppo B trattato con PRL (p<0.05).
I risultati comparativi tra i due gruppi A e B del TMC hanno mostrato nel confronto tra i valori post trattamento una variazione statisticamente significativa tra i due gruppi di terapia, rilevando una maggiore efficacia del trattamento con PRL verso quello esclusivamente medico nel miglioramento della funzione mucociliare (tabella 4).
|
Gr A |
Gr B |
|
|
AAR |
0.33 ± 0.02 Pa/cc3/sec |
0.40 ± 0.06 Pa/cc3/sec |
|
MCTt |
16.9 ± 2 min |
17.55 ± 2 min |
|
Gr A |
Gr B |
|
|
AAR |
0.28 ± 0.03 Pa/cc3/sec |
0.17 ± 0.02 Pa/cc3/sec |
|
MCTt |
14.1 ± 2 min |
14.9 ± 2 min |
Table 4. AAR nasal resistances values and time results at MCT before and after treatment
Il confronto tra i gruppi A e B prima e dopo il trattamento con il questionario SNOT-22 riguardo alle 5 domande più importanti ha mostrato miglioramento per entrambi i gruppi di studio ma con risultati maggiormente favorevoli per efficacia nel gruppo B (tabella 6).
|
Gr A |
Gr B |
|
|
5 most important items (mean) |
23.2 |
20.3 |
|
Gr A |
Gr B |
|
|
5 most important items (mean) |
15.1 |
5.9 |
Table 6. Confronto dei risultati del questionario SNOT-20 per le 5 domande piu importanti before and after treatment nei due gruppi (mean)
Valutazione istologica
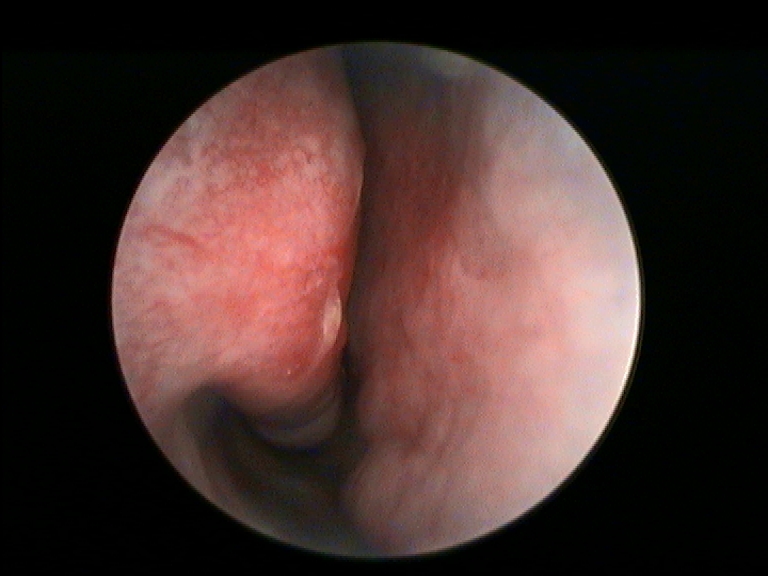
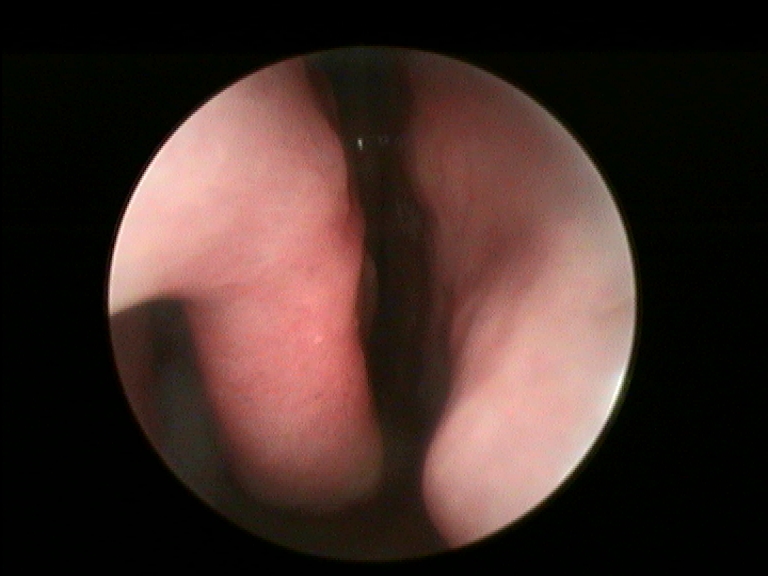
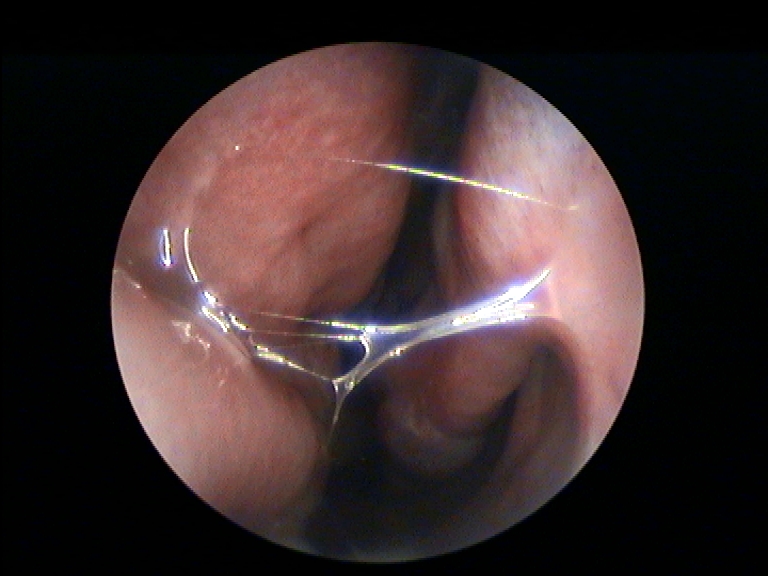
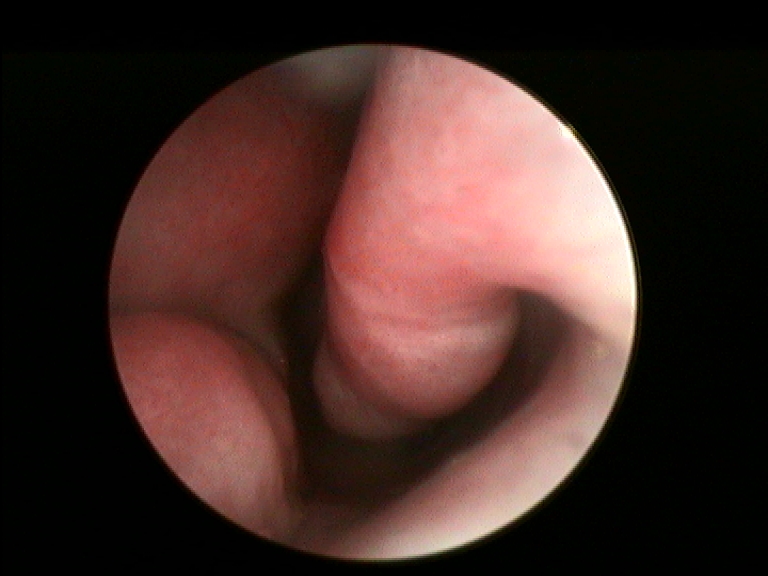
In accordo con i risultati di precedenti esperienze istologiche d’efficacia del FATTORI DI CRESCITA in studi animali e umani, nei campioni dei nostri pazienti esaminati abbiamo rilevato una soddisfacente ricostituzione della mucosa e sottomucosa del turbinato a distanza di almeno 12 mesi dal trattamento con PRL rispetto al controllo preoperatorio (Fig.3 e 4) (14, 15). In particolare a livello delle aree sottoposte a ricostruzione con PRL, si apprezza la riepitelizzazione quasi completa della superficie mucosa del turbinato e la riduzione della quota infiammatoria della sottomucosa.
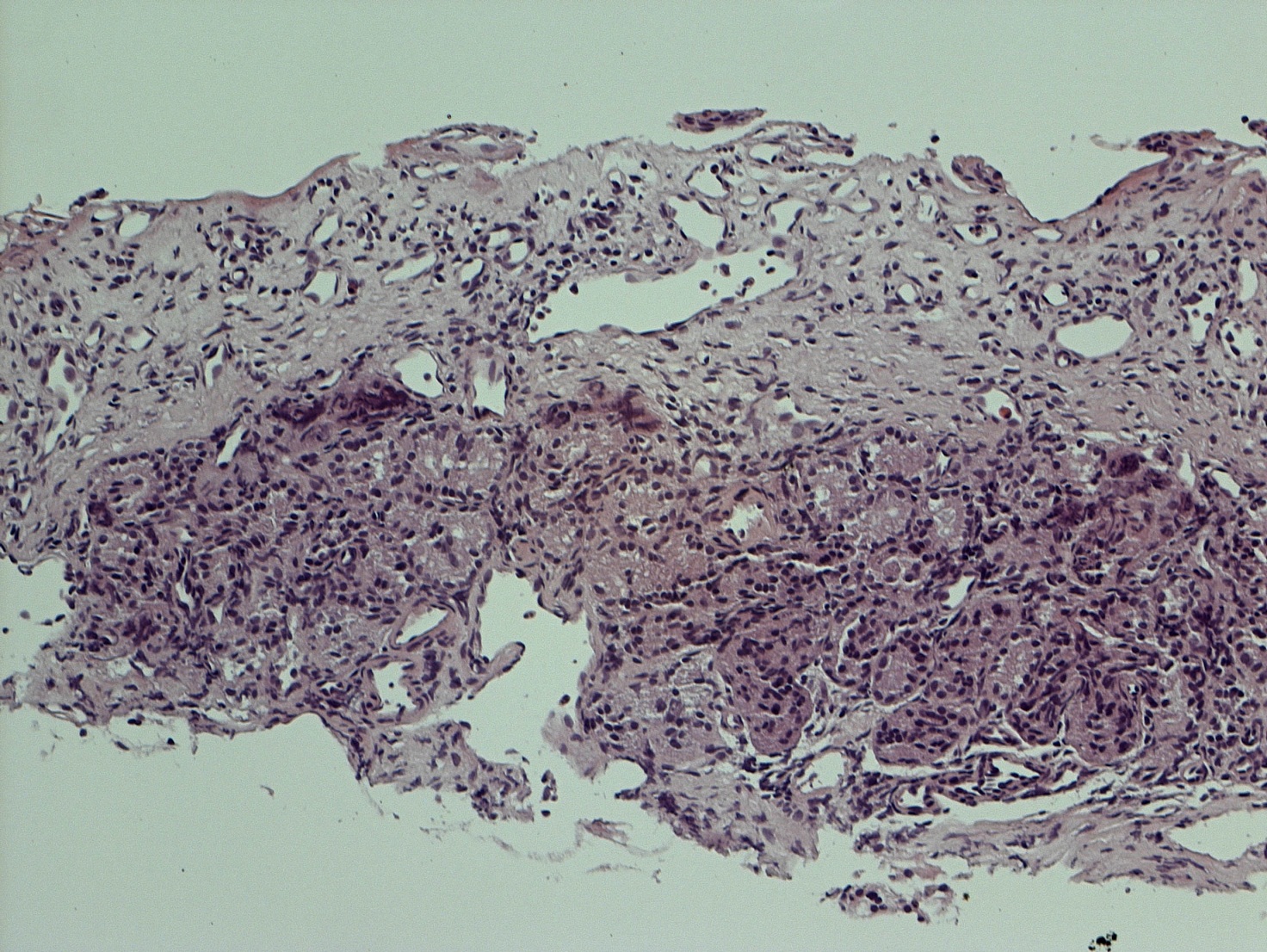
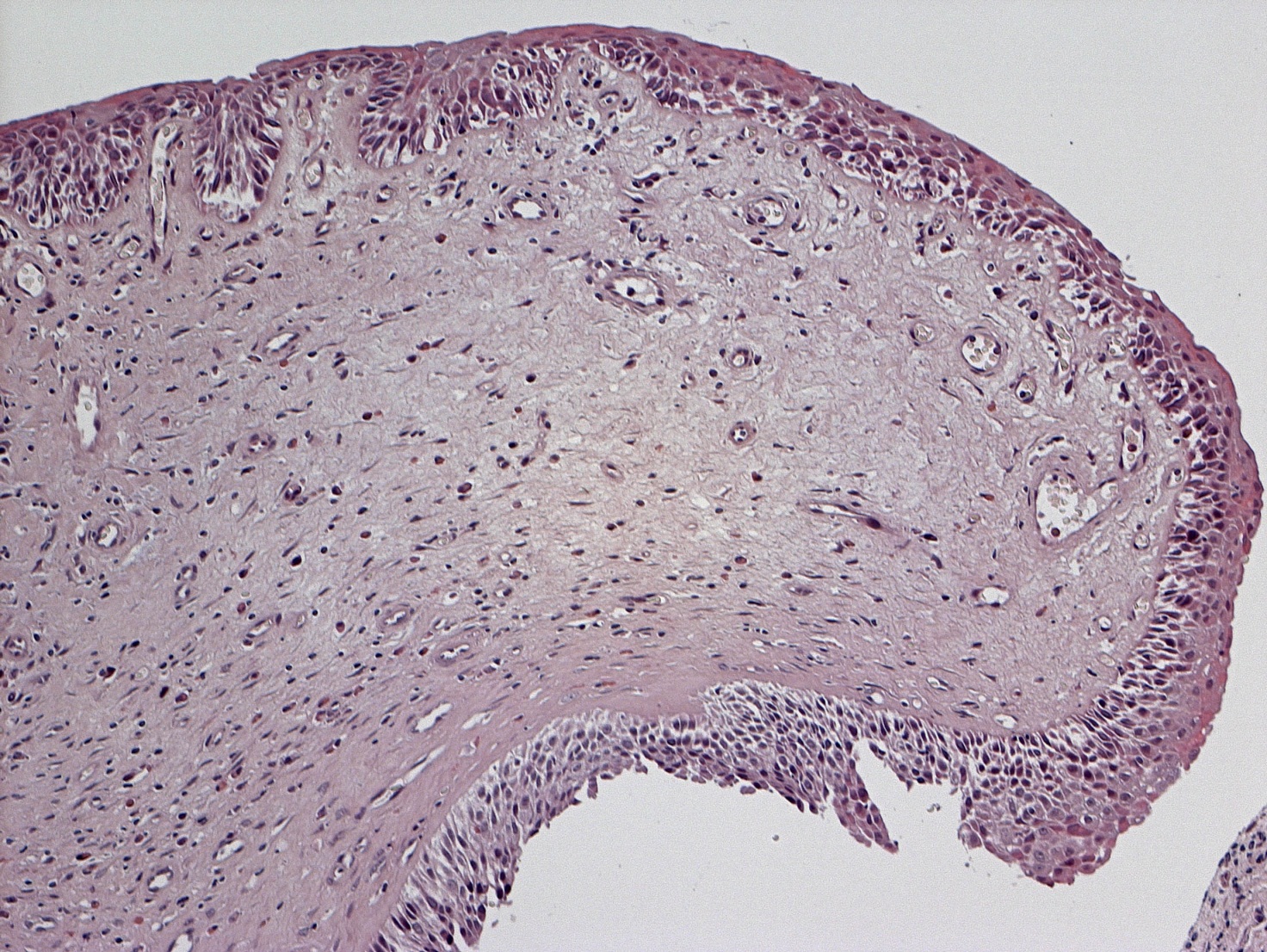
Discussione
I risultati concludono per una maggiore efficacia dell’associazione tra terapia medica e trattamento infiltrativo con PRL, rispetto alla sola terapia medica, nel controllo dei segni e dei sintomi della ENS con amputazione subtotale dei turbinati inferiori.
I sintomi valutati alla VAS hanno dimostrato una maggiore efficacia nel loro controllo da parte dei pazienti del gruppo di trattamento B. In particolare i pazienti cha avevano ricevuto il trattamento con PRL hanno mostrato migliori parametri obiettivi (RAA, score endoscopico) e allo SNOT-22 rispetto al gruppo in sola terapia medica.
I risultati della valutazione del TMC documentano un miglioramento della funzione della superficie mucosa del turbinato dopo ricostruzione con PRL, rilievo molto importante in una categoria di pazienti quali quelli affetti da ENS in cui il danno a carico della clearence mucociliare associato all’atrofia mucosa rappresenta il principale momento patogenetico invalidante nella qualità della vita per la continua formazione e ristagno di croste rapprese nella cavità nasale.
L’associazione del FATTORI DI CRESCITA con le cellule adipose (PRL) ha rappresentato nella nostra esperienza uno dei punti chiave dell’efficacia del trattamento ricostruttivo in termini di ripristino funzionale in quanto entrambe le componenti miscelate insieme contribuiscono al recupero di volume e funzionalità sito-specifiche delle regioni nasali danneggiate o amputate.
È possibile ipotizzare che alla base dei risultati favorevoli ottenuti ci sia un ripristino di neovascolarizzazione regionale nelle regioni sede dell’aumento volumetrico sito-specifico, che unito alle capacità rigenerative dei GF piastrinici hanno condotto al miglioramento obiettivo e sintomatologico (28, 29. 30).
La tecnica chirurgica inoltre si è dimostrata estremamente semplice sia dal punto di vista rinochirurgico che del prelievo del grasso periombelicale, ma soprattutto, in accordo con la letteratura, priva di effetti collaterali (31) o discomfort per il paziente.
Nostri ulteriori studi sono in corso per valutare gli eventuali ulteriori miglioramenti funzionali dopo ripetute sedute di infiltrazioni di PRL nelle medesime sottosedi trattate a distanza di 6 e 12 mesi dalla prima infiltrazione (32) e la stabilità nel tempo dei risultati ottenuti.
Conclusioni
La ricostruzione con PRL dei turbinati inferiori, associata alle terapie mediche topiche di lavaggio e di sostegno emolliente, si sono dimostrate in grado di migliorare in maniera statisticamente significativa i sintomi nasali soggettivi ed i rilievi oggettivi in un gruppo di pazienti affetti da ENS, in particolare con un miglioramento della qualità di vita per quanto concerne i disturbi nasali misurati allo SNOT-22. ******
 |
 |
 |
 |
 |
 |
 |
 |
Bibliografia
- Phillips MJ, Wallace KA, Dickerson SJ, et al. Blood-derived human iPS cells generate optic vesicle-like structures with the capacity to form retinal laminae and develop synapses. Invest Ophtalmol Vis Sci 2012, 18; 53 (4): 2007-19
- Lane MD, Tang QQ. From multipotent stem cell to adipocyte. Birth Defects Res A Clin Mol Teratol 2005;73:476–477
- Rehman J, Traktuev D, Li J et al. Secretion of angiogenic and antiapoptotic factors by human adipose stromal cells. Circulation 2004; 109:1292–1298.
- Nobel Prize in Medicine 2012 Press release. Nobel Foundation, Retrived 2012-10-08
- Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonicand adult fiboblast cultures by defined factors. Cell 2006; 126: 663-76
- Marx RE, Carlson ER, Eichstaedt R, Schimmele SR, Strauss JE and Georgeff KR. Platelet rich plasma: Growth factor enhancement for bone grafts. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1998; 85:638-46
- Marx RE. Platelet-rich plasma: evidence to support its use. J Oral Maxillofac Surg 2004;62:489
- Tiryaki T, Findikli N, Tiryaki D. Staged stem cell-enriched tissue (SET) injections for
- soft tissue augmentation in hostile recipient areas: A preliminary report. Aesthetic Plast
- Surg 2011;35:965–971.
- Anitua E, Andia I, Ardanza B, et al. Autologous platelets as a source of proteins for healing and tissue regeneration. Tromb Haemost 2004; 91: 4
- Cervelli V, Gentile P, Scioli MG et al. Application of platelet-rich plasma in plastic surgery: Clinical and in vitro evaluation. Tissue Eng Part C Methods 2009;15:625– 634.
- Yoshimura K, Asano Y, Aoi N et al. Progenitor-enriched adipose tissue transplantation as
- rescue for breast implant complications. Breast J 2010;16:169 –175.
- Cervelli V, Gentile P, Grimaldi M. Regenerative surgery: Use of fat grafting combined
- with platelet-rich plasma for chronic lower-extremity ulcers. Aesthetic Plast Surg 2009;33: 340–345.
- Cervelli V, Gentile P. Use of cell fat mixed with platelet gel in progressive hemifacial atrophy. Aesthetic Plast Surg 2009;33:22–27.
- Pieri F, Lucareli E, Corinaldesi G, et al. Mesenchymal stem cells and platelet-rich plasma enhance bone formation in sinus grafting: a histomorphometric study in minipigs. J Clin Periodontol 2008;35: 539-546
- Warnke PH, Springer IN, Wiltfang J, et al. Growth and transplantation of a custom vascularized bone graft in a man. Lancet 2004; 364: 766-770
- Cervelli V, Gentile P, De Angelis B et al. Application of enhanced stromal vascular fraction and fat grafting mixed with FATTORI DI CRESCITA in posttraumatic lower extremity ulcers. Stem Cell Res 2011;6:103–111.
- Lozada JL, Caplanis N, Proussaefs P et al. Platelet-rich plasma application in sinus graft
- surgery: Part I. Background and processing techniques. J Oral Implantol 2001;27:38.
- Man D, Plosker H, Winland-Brown JE. The use of autologous platelet-rich plasma (platelet gel) and autologous platelet-poor plasma (fibrin glue) in cosmetic surgery. Plast
- Reconstr Surg 2001;107:229.
- Marlovits S, Mousavi M, Gabler C et al. A new simplified technique for producing platelet-rich plasma: A short technical note. Eur Spine J 2004;13(suppl 1):S102–S106.
- Di Rienzo Businco L, Di Rienzo Businco A, Lauriello M. Comparative study on the effectiveness of Coblation-assisted turbinoplasty in allergic rhinitis. Rhinology. 2010 Jun;48(2):174-8
- Lauriello M, Di Rienzo Businco L, Bonini S, et al. TLR4 and TLR9 Expression in Different Phenotypes of Rhinitis. Int J Otolaryngol. 2012;2012:925164
- Addolorato G, Di Rienzo Businco L, Maurizi M, et al. State and trait anxiety in women affected by allergic and vasomotor rhinitis. J Psychosom Res. 1999 Mar;46(3):283-9.
- Kevy SV, Jacobson MS. Comparison of methods for point of care preparation of autologous platelet gel. J Extra Corpor Technol 2004;36:28 –35.
- Coleman SR. Facial recontouring with lipostructure. Clin Plast Surg 1997;24:347–367.
- Coleman SR. Long-term survival of fat transplants: Controlled demonstrations. Aesthetic
- Plast Surg 1995;19:421– 425.
- Clement PAR, Godts F. Consensus report on acoustic rhinometry and rhinomanometry. Rhinology 2005;43: 169-79
- Passali D, Mezzedimi C, Passali GC, et al. The role of rhinomanometry, acoustic rhinometry, and mucociliary transport-time in the assesment of nasal patency. Ear Nose Throat J 2000;79;397-400
- Prunet-Marcassus B, Cousin B, Caton D et al. From heterogeneity to plasticity in adipose
- tissues: Site-specific differences. Exp Cell Res 2006;312:727–736
- Cao Y, Sun Z, Liao L et al. Human adipose tissue-derived stem cells differentiate into endothelial cells in vitro and improve postnatal neovascularization in vivo. Biochem Biophys Res Commun 2005;332:370 –379.
- Matsumoto D, Sato K, Gonda K et al. Cellassisted lipotransfer: Supportive use of human
- adipose-derived cells for soft tissue augmentation with lipoinjection. Tissue Eng 2006;12:
- 3375–3382
- Gutowski KA; ASPS Fat Graft Task Force. Current applications and safety of autologous
- fat grafts: A report of the ASPS fat graft task force. Plast Reconstr Surg. 2009;124:272–280.
- Zhu M, Zhou Z, Chen Y et al. Supplementation of fat grafts with adipose-derived
- regenerative cells improves long-term graft retention. Ann Plast Surg 2010;64:222–228







Commenti recenti